
张宏研究组揭示钙离子/钙调蛋白依赖性蛋白激酶II β
(CaMKIIβ)解码内质网钙离子瞬变以触发自噬体形成
钙离子(Calcium ion,Ca2+)作为一种多功能第二信使,可调控多种生理过程。Ca2+信号通过各种Ca2+结合效应蛋白进行转导,或通过多种Ca2+及Ca2+/钙调蛋白依赖性蛋白激酶(CDPKs或CaMKs)磷酸化下游分子发挥作用。Ca2+信号高度动态,表现出复杂的时空分布形式。例如Ca2+瞬变在频率、幅度和持续时间上各有不同。CaMKII是解码频率编码Ca2+信号的分子机制之一。CaMKII亚家族有四个成员,α、β、γ和δ,它们在不同组织中的表达不同,在与肌动蛋白结合活性上也有差异。
细胞自噬是指通过形成双层膜结构的自噬体,包裹部分胞质或特定货物(如蛋白质聚集体和受损的细胞器)并运送到溶酶体进行降解及回收的过程。自噬对抵抗各种应激和维持细胞稳态至关重要。自噬功能障碍与人类多种疾病密切相关。自噬体形成的关键步骤包括隔离膜(自噬体前体)的启始、成核、延伸以及闭合。我们前期研究发现内质网表面发生的Ca2+瞬变诱导自噬起始FIP200复合物发生液-液相分离形成FIP200凝聚体,从而启动自噬体的形成。但是内质网表面Ca2+瞬变如何在自噬诱导期间持续发生,以及如何被解码以触发FIP200凝聚体的形成的具体机制还不清楚。
2024年12月31日 ,中国科学院生物物理研究所张宏研究团队在《Molecular Cell》期刊发表的研究论文揭示了CaMKIIβ如何响应内质网Ca2+瞬变以触发自噬起始复合物FIP200的液-液相分离。自噬诱导条件下,内质网表面发生Ca2+瞬变,CaMKIIβ响应Ca2+瞬变从结合的肌动蛋白丝上脱离,形成点状凝聚体,并成为FIP200凝聚体形成的位点。CaMKIIβ可以与FIP200直接结合,并通过磷酸化调节FIP200复合物的液-液相分离及其理化特性,进而调控自噬体的形成过程。研究还发现CaMKIIβ参与控制自噬诱导过程中内质网Ca2+瞬变的幅度、持续时间和传播。而且在神经发育障碍(MRD54)病人中发现的CaMKIIβ突变也会引起自噬的缺陷,提示自噬活性异常可能是导致该类疾病发生发展的重要原因。综上,该研究揭示了CaMKIIβ在维持和解码内质网Ca2+瞬变及自噬体形成过程的重要作用。
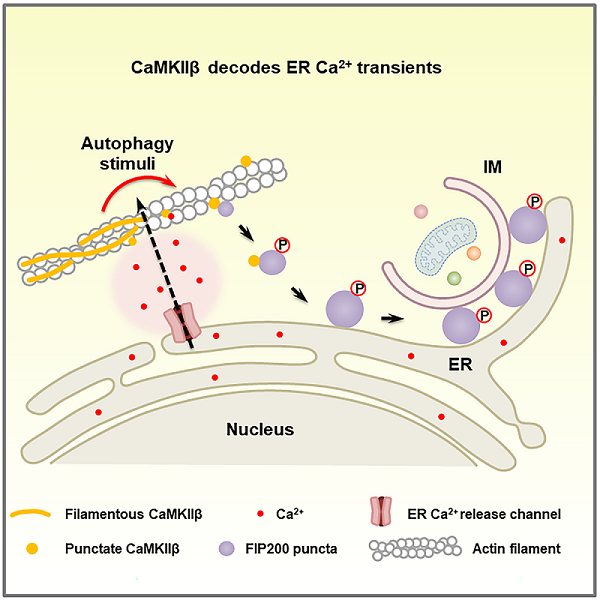
图. 钙离子/钙调蛋白依赖性蛋白激酶II β 解码Ca2+瞬变模式图
中国科学院生物物理研究所张宏研究员为该论文通讯作者,北京大学医学部郑巧霞研究员和中国科学院生物物理研究所博士研究生张焕为论文的共同第一作者。本研究得到国家自然科学基金委和新基石科学基金会的资助。
文章链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(24)01000-1
(供稿:张宏研究组)
附件下载: