
杨鹏远和陈润生研究组合作揭示HBV相关肝癌免疫逃逸新机制
乙型肝炎病毒(hepatitis B virus,HBV)感染是导致我国肝癌(HCC)的最重要因素之一,我国80%以上肝癌患者都源于HBV慢性感染。研究表明HBV感染过程中病毒编码的HBx等抗原可诱导TGF-β信号高度活化,激活肿瘤细胞发生间充质转化或作用于免疫细胞引起免疫耐受促进肿瘤的发生发展,但其调控机制仍有待进一步阐明。
2025年2月28日,中国科学院生物物理研究所杨鹏远研究组和陈润生研究组在《Nature Communications》期刊上发表题为"HBV-associated hepatocellular carcinomas inhibit antitumor CD8+ T cell via the long noncoding RNA HDAC2-AS2"的研究论文,阐明了HBV相关肝癌外泌体中非编码RNA HDAC2-AS2调控免疫逃逸新机制,该研究有望为HBV相关肝癌提供新的诊疗靶标。
研究人员筛选出TGF-β刺激后差异表达最显著的lncRNA--HDAC2-AS2,发现过表达或敲低HDAC2-AS2并不影响肿瘤自身生长,但显著促进C57小鼠皮下肿瘤生长。机制研究表明,肿瘤细胞中的HDAC2-AS2可通过外泌体分泌到微环境里,HCC患者血浆外泌体中也可检测到更高水平的HDAC2-AS2表达。免疫功能研究发现,外泌体中的HDAC2-AS2可以被CD8+ T细胞摄取,通过结合胞内的细胞周期蛋白依赖激酶9(cyclin-dependent kinase 9,CDK9),导致胞内CDK9蛋白水平下降从而诱导CD8+ T细胞的耗竭及凋亡,并抑制CD8+ T细胞杀伤功能。多组学分析发现CDK9在CD8+ T细胞活化和杀伤效应中发挥关键的调节作用。研究团队进一步分析接受ICB治疗肝癌患者的sc-RNA数据库,发现CDK9可以增强ICB治疗时CD8+ T细胞的功能,HDAC2-AS2高表达的肝癌在PD-1抗体治疗中更加获益。
这一研究表明,HBV阳性肝癌中TGF-β信号通路上调的非编码RNA HDAC2-AS2通过外泌体靶向CD8+ T细胞中CDK9蛋白,导致CD8+ T细胞功能受损,促进肿瘤细胞的免疫逃逸,该研究有望为HBV相关肝癌提供新的诊疗靶标。
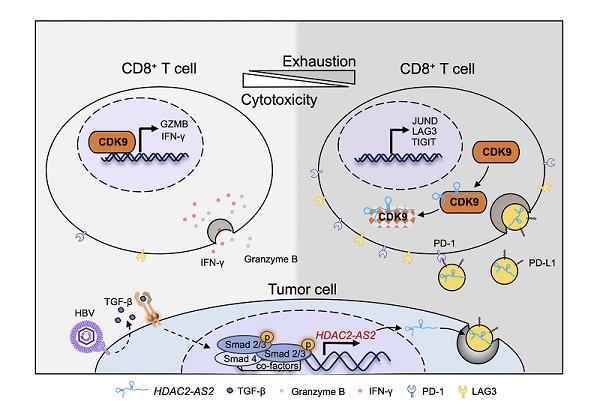
图:肿瘤外泌体中HDAC2-AS2通过拮抗CDK9抑制CD8+ T细胞功能
中国科学院生物物理研究所杨鹏远研究员、陈润生院士和骆健俊研究员为本文的共同通讯作者,高雅楠副研究员、张振兴副研究员、博士研究生黄学涛和游茂军副研究员为本文共同第一作者。该研究得到了国家自然科学基金、国家重点研发计划、北京市科委和中国科学院等项目资助。
文章链接:https://www.nature.com/articles/s41467-025-57367-8
(供稿:杨鹏远研究组)
附件下载: