
李栋研究组揭示融合蛋白通过相变重塑内膜系统并驱动肿瘤发生的新机制
内膜系统的动态重塑是细胞维持区室化功能及稳态调控的核心生物学过程。近年来,富含内在无序区(Intrinsically Disordered Regions,IDRs)的蛋白质通过液-液相分离(Liquid-Liquid Phase Separation,LLPS)形成生物分子凝聚体,通常被称为"无膜细胞器"(Membrane-less organelle)。然而,"无膜细胞器"概念的语义一定程度上误导性地暗示了LLPS过程与膜结构的相互排斥,进而忽视了LLPS对细胞内膜系统重塑的潜在调控作用。尽管体外实验表明,富含IDRs的蛋白质可通过LLPS驱动人工囊泡膜曲率形成,但LLPS在活细胞中是否直接参与内膜系统重塑仍缺乏直接证据。
2025年4月23日,中国科学院生物物理研究所/清华大学生命科学学院李栋教授团队在《Molecular Cell》上发表了题为“Aberrant phase separation drives membranous organelle remodeling and tumorigenesis”的研究论文。研究团队利用Multi-SIM超分辨率成像技术,在活细胞中证实富含IDRs的跨膜融合蛋白可通过LLPS重塑靶向内膜系统。该研究以低级别纤维黏液样肉瘤(Low-Grade Fibromyxoid Sarcoma,LGFMS)特征性融合蛋白FUS-CREB3L2(FC)为模型,系统解析了异常相分离驱动膜重塑促进肿瘤发生的分子机制。
FC蛋白同时保留FUS的IDRs和CREB3L2的跨膜结构域及DNA结合域。通过构建FC诱导表达系统,研究团队利用Multi-SIM连续采集超过2300个时间点、持续六小时的动态影像,首次捕捉到FC通过LLPS重塑内质网(Endoplasmic Reticulum,ER)的动态过程(图1)。
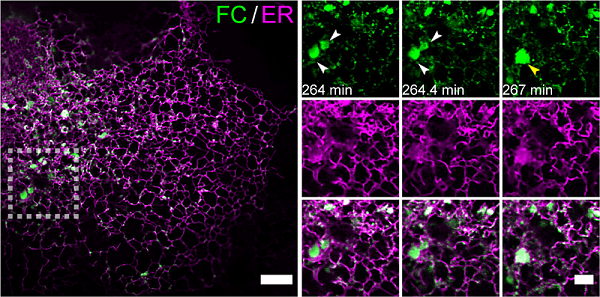
图1 Multi-SIM图像展示了FC在内质网膜上的累积凝聚效应
研究表明,FC重塑的ER膜结构与COPII小泡标志物共定位,形成直径显著大于经典COPII小泡的COPII样区室。值得注意的是,该区室滞留了本应通过COPII转运至高尔基体的S1P/S2P蛋白酶,触发FC发生"自发性"膜内蛋白水解,释放具有转录活性的N端(FC-N)入核(图2A)。这与CREB3L2野生型蛋白形成鲜明对比--后者定位于ER且不改变ER膜形态,其核转移需内质网应激诱导剂布雷菲德菌素A(BFA)刺激,在高尔基体发生"诱导性"切割(图2B)。
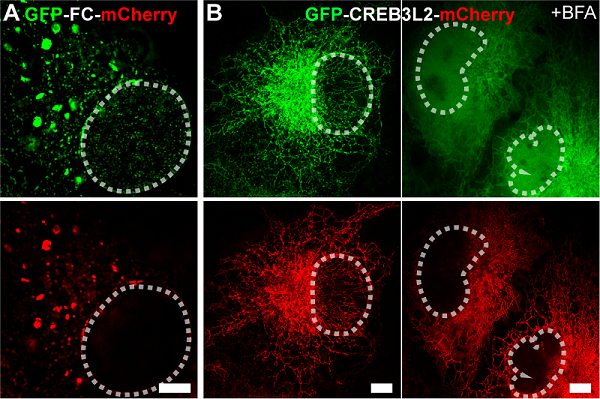
图2 GFP-FC-mCherry融合蛋白(A)和GFP-CREB3L2-mCherry(B)的Multi-SIM图像。比例尺,5 µm
在细胞核内,FC-N特异性募集SSRP1和CHD7形成转录复合物,激活LGFMS特征性基因表达,最终诱导细胞获得恶性表型(图3)。该研究首次阐明FC异常相分离导致的ER膜重塑如何传递至细胞核的调控路径,为开发靶向LGFMS的治疗策略提供了重要理论依据。
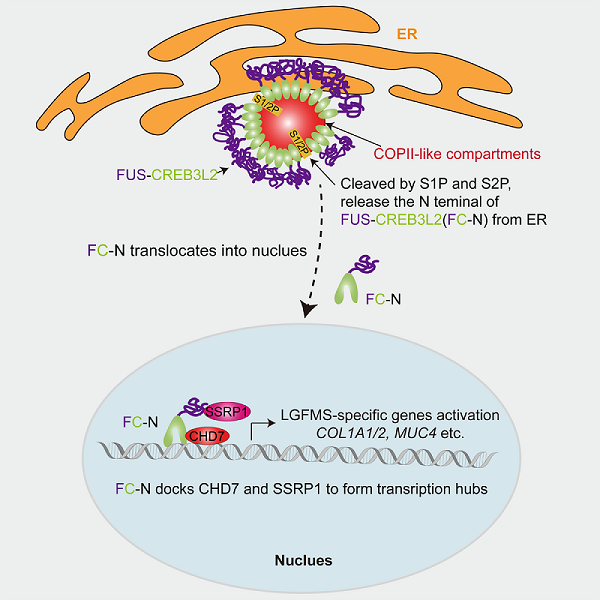
图3 FC致癌机制示意图
中国科学院生物物理研究所/清华大学生命科学学院李栋教授为本文通讯作者;中国科学院生物物理研究所王新禹副研究员、蒋阿敏博士后和清华大学生命学院博士后孟权为共同第一作者。本研究工作获科学技术部、国家自然科学基金委员会、中国科学院、北京市自然科学基金以及新基石科学基金会资助。
文章链接:https://doi.org/10.1016/j.molcel.2025.04.001
(供稿:李栋研究组)
附件下载: