2023年4月24日,《Cell》杂志在线发表了中国科学院生物物理研究所章新政课题组和清华大学医学院向烨课题组合作完成的研究论文"Structure of Semliki Forest virus in complex with its receptor VLDLR"。该工作解析了SFV与人源受体VLDLR复合物的高分辨率冷冻电镜结构,鉴定了一种甲病毒全新的受体结合位点,揭示了受体VLDLR的多个相似串联结构域通过协同作用与SFV特异性结合的新型机制。该研究首次阐释了通用受体分子介导病毒实现跨物种传播的分子机制,为抗病毒药物设计及新型疫苗开发提供了新靶点。
甲病毒(alphavirus)是一类由蚊虫等节肢动物传播的、有囊膜、单链、正义RNA病毒,属于披膜病毒科(Togaviridae),能广泛感染人、鸟、鼠、马等多种动物并引起相关疾病。甲病毒感染人类后可引起发烧、严重且持续的头痛、肌肉疼痛和关节痛。一些甲病毒能感染神经细胞并导致中枢神经系统感染,引发重症脑炎。迄今为止,还没有任何药物或者疫苗被批准用来治疗或者预防甲病毒的感染。近年来,关于甲病毒侵染机制的研究已有一系列重要进展。基孔肯雅热病毒(CHIKV)与其受体Mxra8(matrix remodeling associated protein 8)结合的分子机制和委内瑞拉马脑炎病毒(VEEV)与其受体LDLRAD3(Low-density lipoprotein receptor class A domain-containing protein 3)结合的分子机制均已清晰阐明。然而根据现有研究尚不能解释甲病毒能广泛感染从非脊椎动物到脊椎动物、且进化关系上跨度很大的多种物种的原因。2021年的一篇研究报道表明载脂蛋白受体VLDLR(very-low-density lipoprotein receptor)是多种甲病毒,包括塞姆利基森林病毒(Semliki Forest Virus, SFV),感染蚊虫、鼠、马、人等多个物种的通用受体。介导病毒跨越差异极大的不同物种之间传播的通用受体鲜有报道,病毒与这类受体的结合模式及其介导的跨物种传播机制尚不清楚。
甲病毒囊膜表面有80个三聚体形式的刺突蛋白spike,每个spike由三个E1/E2异源二聚体构成。已有研究普遍认为位于Spike近囊膜区域的E1主要负责病毒与宿主的膜融合,而位于病毒远离囊膜区域spike上的E2参与受体结合。CHIKV与MXRA8复合物和VEEV与LDLRAD3复合物结构研究发现,LDLRAD3和MXRA8都结合在病毒spike上相邻E1-E2二聚体形成的狭缝中,病毒的E1、E2蛋白均参与了与受体的结合。在本研究中,研究人员利用基于分块重构算法的单颗粒冷冻电镜技术,成功解析了SFV VLP及其与受体VLDLR复合物的高分辨率结构,并出乎意料的发现VLDLR结合在SFV E1蛋白贴近囊膜区域的DⅢ结构域(E1-DⅢ)上,且 SFV E2并没有参与和受体VLDLR的结合。这种结合方式与以往发现的甲病毒受体结合方式完全不同,刷新了关于甲病毒与受体相互作用的认知。
研究团队进一步发现VLDLR通过其胞外多个富含半胱氨酸重复序列结构域(LDLR class A repeats,LAs)与SFV E1-DⅢ结合。单个LA结构域与病毒的结合力弱,其解离常数为1-30 M,而多个串联LA结构域与病毒的结合显著增强,其解离常数为1-100 nM。SFV表面受体结合位置E1-DⅢ在二次轴、五次轴附近相互靠近且密集排布,为多个LA结构域可能的协同结合提供了先决条件。通过解析SFV VLP与多个串联LA复合物结构,研究人员发现多个串联的LAs可同时结合SFV VLP多个E1-DIII位点,且并非以一种固定的模式结合,而是存在多种不同的结合模式(图1)。在五次轴附近,多个串联LAs发生轻微的旋转以避免空间上的阻碍并协同结合E1-DⅢ。与单个LA结合时相比,串联形式中的LA虽然在转动过程中大部分与E1-DⅢ的相互作用会被破坏,但是一些关键位点上的相互作用依旧保留着,而且通过串联LAs的协同作用,弥补了单个LA上非关键性相互作用的损失,大大增强了病毒与受体的结合力。从而,这种多个串联LA协同作用模式能够增加受体对单个LA中结合能力丢失的容忍度。不同物种VLDLR大多数LA序列虽然差异较大,但与病毒作用关键残基W132、E137和D139完全保守。VLDLR独特的协同结合模式,使其在介导病毒感染时能够耐受来自不同进化层次物种间序列的差异,实现跨度很大的多物种之间的病毒传播。综上,该研究通过结构生物学手段,结合多种生化方法,首次阐述了多种宿主中进化上相对保守的通用细胞受体通过其多个相似结构域弱相互作用的协同工作与病毒特异性结合,从而介导病毒跨物种入侵的分子机制。
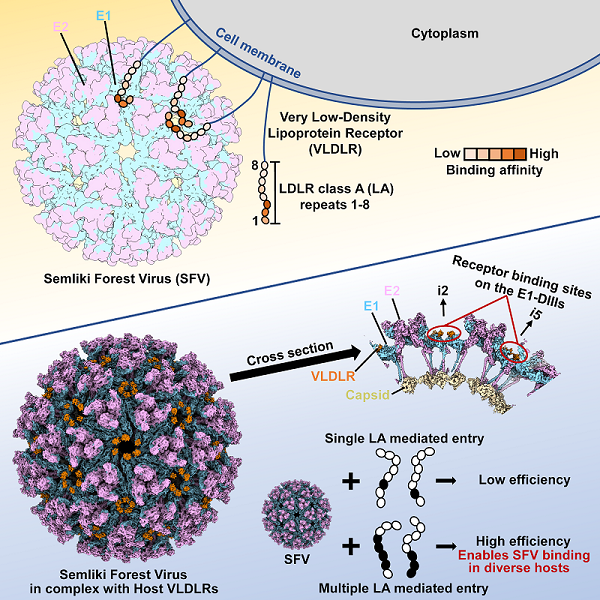
图1. 新型受体通过多个串联LA结构域的协同作用介导甲病毒SFV的跨物种传播
(图源于Cao et al., 2023,Cell186, 1-11)
清华大学医学院向烨研究员和中国科学院生物物理研究所章新政研究员为该论文的共同通讯作者,章新政课题组副研究员曹端方、向烨课题组博士后马丙婷和章新政课题组博士研究生曹紫怡为该论文的共同第一作者。这项工作得到了中国科技部重点研发项目、清华大学万科公共卫生与健康学科发展专项基金、国家自然科学基金、清华大学春风基金、北京生物结构前沿研究中心、中国科学院战略性先导科技专项、中国科学院基础前沿科学研究计划和中国科学院青年创新促进会的基金支持。
文章链接:https://www.cell.com/cell/fulltext/S0092-8674(23)00329-X#secsectitle0080
(供稿:章新政研究组)
 附件下载:
附件下载: