肠道病毒是人群中流行最为广泛的病毒之一,不同家族不同血清型在不同国家地区及不同时间维度上层出不穷。一方面,当一种血清型在某一地区大规模流行,疫苗的介入使得易感人群对其产生群体免疫效力,导致该血清型被压制,但同时另外一种或几种血清型则会出现,经过一段时间的进化,逐渐成为感染某一特定人群的主要病原。例如,EV71疫苗出现后,我国EV71的感染人数大大减少,但却伴随着CVA10、CVA6、埃可病毒等血清型流行的增加。肠道病毒流行谱的变化提示我们有必要对一些常见的以埃可病毒为代表的流行范围较为广泛的病毒血清型做充分的认识,为未来潜在的疫情做充足准备。埃可病毒30(echovirus 30, E30)型为人源性肠道病毒B家族的一个重要成员,是引起人病毒性脑炎和脑膜炎最主要的病原体之一;近年来,在欧洲、亚洲以及南美洲呈较大规模的季节性和周期性流行。然而,人们对该家族成员的抗原特征、免疫特性以及入侵机制却知之甚少,目前也尚无能够用于防治肠道病毒B家族成员感染的特异性药物或疫苗。
2020年9月4日,国际学术期刊《Nature Communications》以背靠背的形式在线刊发了由中国科学院生物物理研究所王祥喜研究员/饶子和院士团队,联合江苏省疾病预防控制中心朱凤才研究员团队共同完成的题目分别为"Structures of Echovirus 30 in complex with its receptors inform a rational prediction for enterovirus receptor usage"与"Serotype specific epitopes identified by neutralizing antibodies underpin immunogenic differences in Enterovirus B subtypes"的研究型长文。研究对E30的原子结构、细胞入侵机制及中和机理进行了深入剖析,为下一步针对肠道病毒的受体使用预测、免疫特性及该病毒家族的特异性药物或疫苗的开发奠定了基础。这是该团队继完成对肠道病毒EV71,CVA16,CVA10及甲肝病毒HAV等不同生命周期的全颗粒结构和相关功能系列研究后的又一重要成果(Wang, X. et.al.Nat Struct Mol Biol2012; Ren, J. et al.Nat Commun2013; Luigi, De. et al.Nat Struct Mol Biol2014; Wang, X. et al.Nature2015; Wang, X. et al.PNAS2017; Zhu, L. et al.mBio2018;Zhu, L. et.al.Nat Commun2018; Cao, L. et al.PLoS Biology2019)。
在本研究中,研究人员首先借助冷冻电镜技术,捕获并解析了处于不同生命周期的E30病毒颗粒的原子结构,即分辨率分别为3.4 Å、2.9 Å与2.9 Å的未成熟的空心态(E)颗粒、脱衣壳的中间态(A)颗粒以及成熟的全病毒(F)颗粒。结构分析显示E颗粒与F颗粒均呈典型的“闭合”状态,二者表面结构非常相似,且均表现为高度有序化,提示二者可以用于潜在的疫苗开发。这与本研究中基于细胞及动物水平的免疫实验结果相一致。E30与肠道病毒A、B和C家族的代表性成员的结构比较显示各成员病毒蛋白质1(viral protein 1, VP1) BC loop呈现高度不保守,提示其可作为区别不同肠道病毒血清型的重要结构特征;各成员VP1 GH loop和VP2 EF loop则相对保守,提示二者可以作为设计广谱性抗肠道病毒B家族成员抗体的重要靶标。
接着,研究人员解析了分辨率分别为3.3 Å和3.6 Å的E30与其脱衣壳受体 - 新生儿Fc受体(human neonatal Fc receptor, FcRn)以及E30与其吸附受体 - 衰变加速因子(decay-accelerating factor, DAF/CD55)的复合物结构,从原子水平上阐明了E30与其特异性受体识别与结合的结构基础。进一步分析发现:肠道病毒VP1 EF loop、VP1 GH loop以及VP2 EF loop共同构成了肠道病毒及其脱衣壳受体识别的分子基础。基于此,研究人员利用计算不同病毒目标区域同源位点距离得到的k维向量以及不同病毒对间的距离矩阵,开发了能够合理预测肠道病毒脱衣壳受体的计算方法(图1)。
此外,研究人员还筛选得到两株具较高中和活性且高度特异的单克隆抗体 - 6C5和4B10。竞争性表面等离子体共振(surface plasmon resonance, SPR)实验以及实时荧光定量PCR(real-time PCR)实验等都提示这两株抗体是通过阻断E30及其受体的特异性结合从而发挥中和活性的。有意思的是,相关实验表明,两株抗体具有协同互补的作用,二者的同时使用能够起到1+1>2效应。高分辨率的E30与6C5-Fab(3.1 Å)以及E30与4B10-Fab(3.7 Å)的复合物结构显示: 6C5结合于病毒峡谷区的边缘而4B10结合于病毒峡谷区的内部;构成这两个中和性抗体所识别的构象型表位在肠道病毒B家族内部是相对不保守的。以上原子分辨率的结构信息为今后避开不保守区而主要针对保守区的广谱性疫苗或者药物的设计提供了重要依据。
王祥喜研究员、饶子和院士和朱凤才研究员为文章的共同通讯作者。南开大学-生物物理研究所联合培养的博士研究生王康、江苏省疾病预防控制中心的崔仑标博士、张黎博士为两篇文章的共同第一作者。本项目还得到中科院微生物研究所高福院士团队和中科院动物研究所翟巍巍研究员团队的大力支持。该研究受到中科院先导项目、自然科学基金委创新群体、科技部重点研发项目、北京市海淀联合基金等项目资助。
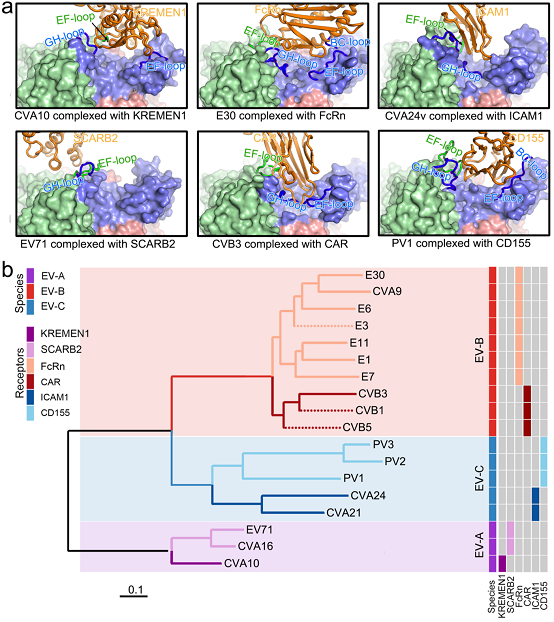
图1. 病毒与受体结合的结构基础及基于结构进行受体预测的计算方法的开发
文章链接:https://www.nature.com/articles/s41467-020-18251-9
https://www.nature.com/articles/s41467-020-18250-w
(供稿:王祥喜研究组)