
范克龙/阎锡蕴团队开发铁蛋白靶向递送siRNA治疗脑胶质瘤新策略
siRNA能抑制特定致癌基因表达,展现出较好的抗肿瘤潜力。然而其临床应用面临多重障碍,如负电荷亲水性阻碍细胞摄取,溶酶体逃逸能力不足导致降解风险,肿瘤靶向性差以及易被肾脏快速清除。尤其在治疗脑胶质瘤时,传统药物递送系统还面临血脑屏障的巨大挑战。因此,开发兼具跨越血脑屏障和特异性靶向肿瘤的siRNA递送载体,成为推进脑瘤RNAi治疗的关键突破口。
2025年2月19日,中国科学院生物物理研究所范克龙和阎锡蕴团队在《Science Advances》期刊上发表题为"Bioengineered protein nanocarrier facilitating siRNA escape from lysosomes for targeted RNAi therapy in glioblastoma"的研究论文,利用铁蛋白设计了靶向脑胶质瘤的siRNA递送系统。研究团队十余年的系统性研究揭示,人源重链铁蛋白(HFn)具有特异性识别肿瘤和跨越血脑屏障的特性。但铁蛋白递送siRNA还需突破溶酶体逃逸的关键瓶颈。基于以上工作基础,研究人员针对siRNA递送的特殊需求对铁蛋白进行改造,成功构建了具有溶酶体逃逸功能的铁蛋白载体。
研究人员设计了一系列内表面带正电且C端截短的铁蛋白突变体,通过结构性质以及溶酶体逃逸能力的系统性评价,从中优选得到新型递送载体--tHFn(+)。该纳米载体可以在内体(endosome)的弱酸环境中解聚以释放siRNA,同时暴露出内部正电荷,介导溶酶体逃逸。通过冷冻电镜结构解析,验证了该蛋白具有弱酸响应性的机制,即C端截短后,界面间的相互作用减弱,使其能在内体的酸性环境中解聚。在体外实验中,该载体可以实现siRNA的胞质递送,最终高效敲低目的基因表达。体内外研究均表明,tHFn(+)能穿越血脑屏障,特异性靶向脑胶质瘤。此外,tHFn(+)载体递送的siTERT和siEGFR在小鼠模型中表现出卓越的治疗效果。
本研究设计的铁蛋白载体在递送针对不同靶点的siRNA分子时展现了高效性和普适性,为肿瘤、遗传病等相关疾病的RNAi治疗提供了新策略和新平台,具有广阔的临床应用前景。
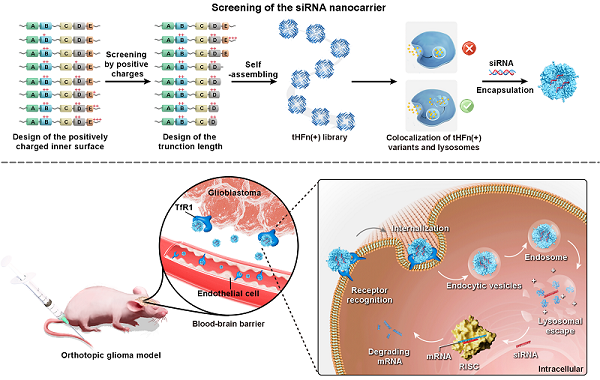
图:siRNA铁蛋白载体的设计、筛选及其在脑胶质瘤靶向治疗中应用的示意图
中国科学院生物物理研究所范克龙研究员和阎锡蕴院士为本文的共同通讯作者,博士研究生金奕良及张宝丽为共同第一作者。北京大学郭振玺、郭振乾老师为冷冻电镜结构解析提供了重要指导,北京理工大学黄渊余教授为脂质纳米颗粒的合成提供了支持和帮助。该研究得到了国家重点研发计划、国家自然科学基金、中国科学院创新交叉团队等项目的资助。
文章链接:https://www.science.org/doi/10.1126/sciadv.adr9266
(供稿:范克龙研究组)
附件下载: