2020年12月16日,《发育细胞》(Developmental Cell)杂志发表了中国科学院生物物理研究所张宏课题组题为 "ORF3a of the COVID-19 virus SARS-CoV-2 blocks HOPS complex-mediated assembly of the SNARE complex required for autolysosome formation" 的研究论文,该文揭示了SARS-CoV-2病毒编码的辅助蛋白ORF3a通过阻断HOPS复合物介导的SNARE复合体组装,从而抑制自噬溶酶体形成的机制。
细胞自噬(autophagy)是一种真核生物中高度保守的由溶酶体介导的降解系统。自噬通过形成双层膜的自噬体包裹部分细胞质,并运输至溶酶体进行降解,对细胞应对各种应激条件以及维持稳态平衡至关重要。细胞自噬作为一种细胞监测机制也参与抵抗外来入侵的细菌或病毒。当病毒感染时,宿主细胞通过多种通路激活自噬活性,将病毒或病毒蛋白运送到溶酶体进行降解,激活先天性和适应性免疫反应,或调节病毒诱导的细胞死亡,从而抵御病毒感染。病毒也进化出各种策略以逃避自噬检测,甚至利用自噬通路的膜结构完成自身的复制和释放。目前对COVID-19的致病病毒SARS-CoV-2破坏细胞功能导致疾病发生的机制知之甚少。因此,阐明SARS-CoV-2编码的蛋白质,特别是其他冠状病毒中不保守的辅助蛋白是如何与宿主因子相互作用的,对于我们理解SARS-CoV-2的高传染性和致病性,以及研发潜在的COVID-19治疗方法至关重要。
这篇研究论文证明了SARS-CoV-2编码的辅助蛋白ORF3a通过阻断自噬体与溶酶体的融合进而抑制自噬的活性,逃避降解。研究发现,ORF3a定位于晚期内吞体/溶酶体,它直接与膜泡上的HOPS复合体的VPS39亚基相互作用,并使其在晚期内吞体聚集,进而抑制HOPS复合体与位于自噬体上的SNARE蛋白STX17的相互作用,从而阻碍介导自噬体与晚期内吞体/溶酶体融合的STX17-SNAP29-VAMP8 SNARE复合体的组装。ORF3a也抑制溶酶体的功能,并导致溶酶体损伤。与ORF3a表达相似,SARS-CoV-2病毒感染也导致VPS39亚基在晚期内吞体聚集,阻断自噬溶酶体的形成,抑制自噬活性。SARS-CoV-2编码的ORF3a与SARS-CoV的编码的ORF3a具有约72%的同源性,85%的相似性。但让人惊讶的是,SARS-CoV编码的辅助蛋白ORF3a却不与HOPS相互作用,也不能抑制自噬过程。
该研究首次揭示COVID-19的致病病毒SARS-CoV-2编码的辅助蛋白ORF3a通过阻断自噬体与溶酶体的融合来抑制自噬活性、逃脱自噬降解的新机制,对于理解SARS-CoV-2的高传染性和致病性以及开发潜在的COVID-19治疗方法有重要意义。
中国科学院生物物理研究所张宏研究员为本文的通讯作者,副研究员苗广艳为本文的第一作者。该课题获得国家重点研发计划、国家自然科学基金、北京市科委、中国科学院战略性先导科技项目(B类)等项目的资助。
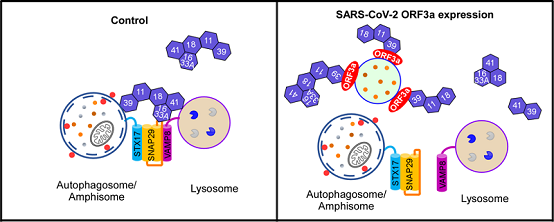
图1. ORF3a通过阻断HOPS复合物介导的SNARE复合体组装抑制自噬溶酶体的形成
文章链接:https://www.cell.com/developmental-cell/fulltext/S1534-5807(20)31016-9
(供稿:张宏研究组)
 附件下载:
附件下载: